Mentol
| |||

| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
(1R,2S,5R)-2-isopropil-5-metilsikloheksanol
| |||
| Nama lain
3-p-Mentanol,
Heksahidrotimol, Mentomentol, kapur barus pudina | |||
| Pengecam | |||
Imej model 3D Jmol
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.016.992 | ||
| Nombor RTECS |
| ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| C10H20O | |||
| Jisim molar | 156.27 g·mol−1 | ||
| Rupa bentuk | Pepejal hablur putih atau tanpa warna | ||
| Ketumpatan | 0.890 g·sm-3, pepejal (racemic atau (-)-isomer) | ||
| Takat lebur | 36–38 °C (311 K), racemic 42–45 °C (318 K), (−)-form (α) 35-33−31 °C, (−)-isomer | ||
| Takat didih | 212 °C (485 K) | ||
| Larut sedikit, (-)-isomer | |||
| Bahaya | |||
| Bahaya-bahaya utama | Merengsakan, mudah terbakar | ||
| Frasa R | Templat:R37/38, Templat:R41 | ||
| Frasa S | S26, S36 | ||
| Takat kilat | 93 °C | ||
| Sebatian berkaitan | |||
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |||
| | |||
| Rujukan kotak info | |||
Mentol merupakan sebatian organik yang diperbuat secara sintetik ataupun diperolehi daripada minyak-minyak pudina. Ia merupakan bahan berlilin dan berhamblur, berwarna jernih atau putih, yang berkeadaan pepejal pada suhu bilik dan mencair pada suhu melebihi suhu bilik. Bentuk utama mentol secara semula jadi ialah (−)-mentol. Mentol mempunyai keupayaan anestetik tempatan dan penawar kerengsaan, dan sering digunakan secara meluas untuk melegakan sakit tekak ringan. Sifat mentol yang mengujakan rasa dingin serta keupayaan analgesiknya menyebabkan mentol digunakan secara meluas dalam merawat penyakit-penyakit ringan seperti sakit tekak, batuk, dsb.
Struktur
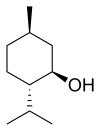
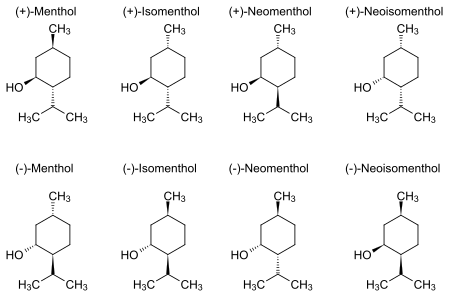
[sunting | sunting sumber]Mentol semula jadi wujud sebagai satu stereoisomer tulen, hampir sentiasa dalam bentuk (1R,2S,5R) (bahagian penjuru bawah kiri pada gambar di bawah). Lapan stereoisomer yang mungkin ialah:
Dalam sebatian semula jadi, kumpulan isopropil adalah dalam orientasi trans pada kedua-dua kumpulan metil dan hidroksil. Oleh itu, ia boleh dilukis dalam pelbagai cara seperti di bawah:
Enantiomer (+) dan (–) mentol adalah yang paling stabil antara kesemuanya berasaskan konformasi sikloheksananya. Dengan cecincin itu sendiri di dalam konformasi kerusi, ketiga-tiga kumpulan pukal berorientasi di kedudukan yang seimbang.
Dua bentuk hablur bagi mentol rasemik mempunyai takat lebur pada 28 °C dan 38 °C. (−)-mentol tulen mempunyai empat bentuk hablur, yang mana bentuk paling stabil ialah bentuk α, iaitu bentuk jejarum yang dikenali.
Sifat biologi
[sunting | sunting sumber]Keupayaan mentol untuk memicu reseptor TRPM8 yang sensitif pada keadaan sejuk secara kimia bertanggungjawab kepada rasa sejuk yang diujakannya apabila dihidu, dimakan, atau disapu pada kulit.[1] Dalam keadaan ini, ia menyerupai kapsaisin, sejenis bahan kimia yang bertanggungjawab mengujakan rasa pedas cili (yang menstimulasikan reseptor haba, juga tanpa menyebabkan perubahan sebenar suhu).
Tindak balas
[sunting | sunting sumber]Mentol bertindak balas dalam pelbagai cara seperti alkohol sekunder biasa. Ia teroksida kepada mentona oleh agen pengoksidaan seperti asid kromik atau dikromat,[2] walaupun sesetengah keadaan pengoksidaan boleh melangkau jauh sehingga memecahkan cecincin. Mentol mudah terdehidrat untuk menghasilkan terutamanya 3-mentena, oleh tindakan asid sulfurik 2%. Fosforus pentaklorida (PCl5) menghasilkan mentil klorida.
Sejarah
[sunting | sunting sumber]Terdapat bukti[3] bahawa mentol sudah lama digunakan di Jepun selama lebih 2000 tahun, tetapi di Barat pula penggunaannya tidak diketahui sehingga tahun 1771, oleh Hieronymus David Gaubius.[4] Perwatakan terawalnya dilakukan oleh Oppenheim,[5] Beckett,[6] Moriya,[7] dan Atkinson.[8]
Nota dan rujukan
[sunting | sunting sumber]- ^ R. Eccles (1994). "Menthol and Related Cooling Compounds". J. Pharm. Pharmacol. 46 (8): 618–630. PMID 7529306.
- ^ L. T. Sandborn. "l-Menthone". Organic Syntheses.; Collective Volume (dalam bahasa Inggeris), 1, m/s. 340
- ^ J. L. Simonsen (1947). The Terpenes, Volume I (ed. 2nd). Cambridge University Press. m/s. 230–249.
- ^ Adversoriorum varii argumentii, Liber unus, Leiden, 1771, p99.
- ^ A. Oppenheim (1862). "On the camphor of peppermint". J. Chem. Soc. 15: 24. doi:10.1039/JS8621500024.
- ^ G. H. Beckett and C. R. Alder Wright (1876). "Isomeric terpenes and their derivatives. (Part V)". J. Chem. Soc. 29: 1. doi:10.1039/JS8762900001.
- ^ M. Moriya (1881). "Contributions from the Laboratory of the University of Tôkiô, Japan. No. IV. On menthol or peppermint camphor". J. Chem. Soc., Trans. 39: 77. doi:10.1039/CT8813900077.
- ^ R. W. Atkinson and H. Yoshida (1882). "On peppermint camphor (menthol) and some of its derivatives". J. Chem. Soc., Trans. 41: 49. doi:10.1039/CT8824100049.
Bacaan lanjut
[sunting | sunting sumber]- E. E. Turner, M. M. Harris, Organic Chemistry, Longmans, Green & Co., London, 1952.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960.
- Perfumer & Flavorist, December, 2007, Vol. 32, No.12, Pages 38–47
Lihat juga
[sunting | sunting sumber]Pautan luar
[sunting | sunting sumber]| Wikimedia Commons mempunyai media berkaitan: Menthol. |
- Colacot T. J. Platinum Metals Review 2002, 46(2), 82-83.
- Ryoji Noyori Nobel lecture (2001)
- Menthol Information
- A review of menthol from the Science Creative Quarterly