Penyusunan semula Favorskii
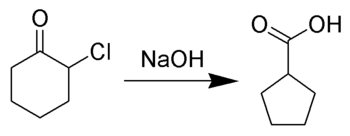
Penyusunan semula Favorskii pada dasarnya adalah penyusunan semula siklopropanon dan α-halo keton yang membawa kepada terbitan asid karboksilik. Dalam kes keton α-halo kitaran, penyusunan semula Favorskii membentuk penguncupan cincin. Penyusunan semula ini berlaku dengan kehadiran bes, kadangkala hidroksida, untuk menghasilkan asid karboksilik tetapi kebanyakan masa sama ada bes alkoksida atau amina masing-masing menghasilkan ester atau amida. α,α'-Dihaloketones menghilangkan HX di bawah keadaan tindak balas untuk memberikan sebatian karbonil α,β-tak tepu. [1][2]
Sejarah
[sunting | sunting sumber]Reaksi ini dinamakan untuk ahli kimia Rusia Alexei Yevgrafovich Favorskii.[3][4][5]
Mekanisme tindak balas
[sunting | sunting sumber]Mekanisme tindak balas dianggap melibatkan pembentukan enolat pada sisi keton dari atom klorin. Enolat ini berkitar kepada perantaraan siklopropanon yang kemudiannya diserang oleh nukleofil hidroksida.


Langkah kedua juga telah dicadangkan untuk proses berperingkat, dengan anion klorida meninggalkan dahulu untuk menghasilkan kation oksiallyl zwitterionic sebelum penutupan cincin elektrosiklik disrotatory berlaku untuk membeli perantaraan siklopropanon.[6]
Penggunaan anion alkoksida seperti natrium metoksida, bukannya natrium hidroksida, menghasilkan produk ester berbentuk cincin mengecil.
Apabila pembentukan enolat adalah mustahil, penyusunan semula Favorskii akan berlaku dengan mekanisme alternatif, di mana penambahan hidroksida kepada keton berlaku, diikuti dengan keruntuhan bersepadu perantaraan tetrahedral dan penghijrahan karbon jiran dengan anjakan halida. Perkara ini kadangkala dikenali sebagai penyusunan semula pseudo-Favorskii, walaupun sebelum kajian pelabelan, adalah dianggap bahawa semua penyusunan semula Favorskii diteruskan melalui mekanisme ini.
 </img> </img>
|
| Animasi mekanisme tindak balas |
Kemerosotan Wallach
[sunting | sunting sumber]Dalam kemerosotan Wallach yang berkaitan (Otto Wallach, 1918) bukan satu tetapi dua atom halogen mengapit keton menghasilkan keton mengecut baru selepas pengoksidaan dan dekarboksilasi[7][8]
Tindak balas foto-Favorskii
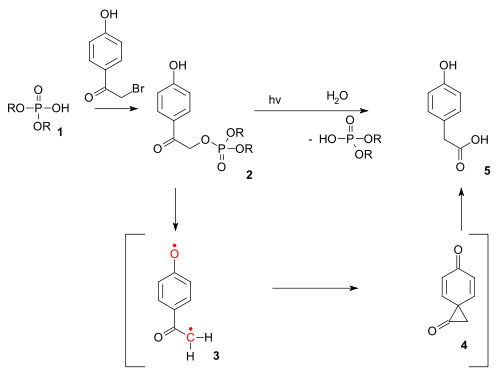
[sunting | sunting sumber]Jenis tindak balas juga wujud sebagai tindak balas fotokimia . Tindak balas foto-Favorskii telah digunakan dalam pembuka kunci fotokimia fosfat tertentu (contohnya ATP ) yang dilindungi oleh kumpulan p-hydroxyphenacyl yang dipanggil. [9] Penyahlindungan diteruskan melalui triplet diradical (3) dan dione spiro intermediate (4) walaupun yang terakhir setakat ini telah mengelak pengesanan. [10]
Lihat juga
[sunting | sunting sumber]- Sintesis cubane diteruskan dengan penyusunan semula Favorskii:
- Trimethylenemethane cycloaddition, yang boleh diteruskan melalui mekanisme yang serupa
Rujukan
[sunting | sunting sumber]- ^ Cope, Arthur (1960). Organic Reaction Volume XI (ed. 1). New York: Wiley-Interscience. doi:10.1002/jps.2600500225. ISBN 9780471171270.
- ^ Shioiri, Takayuki; Kawai, Nobutaka (1978). "New methods and reagents in organic synthesis. 2. A facile conversion of alkyl aryl ketones to α-arylalkanoic acids using diphenyl phosphorazidate. Its application to a new synthesis of ibuprofen and naproxen, nonsteroidal antiinflammatory agents". J. Org. Chem. 43 (14): 2936–2938. doi:10.1021/jo00408a049.
- ^ Favorskii, A. E. (1894). J. Russ. Phys. Chem. Soc. 26: 590. Missing or empty
|title=(bantuan) - ^ Favorskii, A. E. (1905). J. Russ. Phys. Chem. Soc. 37: 643. Missing or empty
|title=(bantuan) - ^ Faworsky, A. Y. (1913). "Über die Einwirkung von Phosphorhalogenverbindungen auf Ketone, Bromketone und Ketonalkohole". J. Prakt. Chem. (dalam bahasa Jerman). 88 (1): 641–698. doi:10.1002/prac.19130880148.
- ^ Akhrem, A A; Ustynyuk, T K; Titov, Yu A (1970-09-30). "The Favorskii Rearrangement". Russian Chemical Reviews. 39 (9): 732–746. Bibcode:1970RuCRv..39..732A. doi:10.1070/rc1970v039n09abeh002019. ISSN 0036-021X.
- ^ Wallach, O. (1918). "Zur Kenntnis der Terpene und der ätherischen Öle. Über das Verhalten zweifach gebromter hexacyclischer Ketone in Abhängigkeit von der Stellung der Bromatome". Justus Liebigs Ann. Chem. (dalam bahasa Jerman). 414 (3): 271–296. doi:10.1002/jlac.19184140303.
- ^ Wallach, O. (1918). "Zur Kenntnis der Terpene und der ätherischen Öle". Justus Liebigs Ann. Chem. (dalam bahasa Jerman). 414 (3): 296–366. doi:10.1002/jlac.19184140304.
- ^ Park, Chan-Ho; Givens, Richard S. (1997). "New Photoactivated Protecting Groups. 6. p-Hydroxyphenacyl: A Phototrigger for Chemical and Biochemical Probes". J. Am. Chem. Soc. 119 (10): 2453–2463. doi:10.1021/ja9635589.
- ^ Givens, Richard S.; Heger, Dominik; Hellrung, Bruno; Kamdzhilov, Yavor; Mac, Marek; Conrad, Peter G.; Cope, Elizabeth; Lee, Jong I.; Mata-Segreda, Julio F. (2008). "The Photo-Favorskii Reaction of p-Hydroxyphenacyl Compounds is Initiated by Water-Assisted, Adiabatic Extrusion of a Triplet Biradical". J. Am. Chem. Soc. 130 (11): 3307–3309. doi:10.1021/ja7109579. PMC 3739295. PMID 18290649.
Bacaan lanjut
[sunting | sunting sumber]- Chenier, Philip J. (1978). "Favorskii rearrangement in bridged polycyclic compounds". Journal of Chemical Education. 55 (5): 286. Bibcode:1978JChEd..55..286C. doi:10.1021/ed055p286.