Aromatisasi
Aromatisasi ialah sebuah tindak balas kimia di mana sistem aromatik terbentuk daripada prekursor nonaromatik yang tunggal. Biasanya aromatisasi dicapai dengan penyahhidrogenan sebatian kitaran sedia ada, seperti penukaran sikloheksana kepada benzena. Proses aromatisasi termasuk dalam pembentukan sistem heterosiklik.

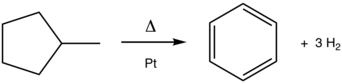
Penukaran metilsikloheksana kepada toluena ialah tindak balas aromatisasi klasik. Proses bermangkin platinum (Pt) ini diamalkan secara berskala dalam pengeluaran petrol daripada petroleum.
Amalan industri
[sunting | sunting sumber]Walaupun tidak diamalkan di bawah nama aromatisasi, proses ini merupakan salah satu tindak balas asas untuk penapisan minyak. Salah satu tindak balas pembaharuan utama ialah penyahhidrogenan naftena menjadi aromatik. Proses tersebut, yang dimangkinkan oleh platinum, dicontohkan dalam penukaran metilsikloheksana (naphthene) kepada toluena (aromatik). [1] Penyahsiklosasi menukarkan parafin (hidrokarbon asiklik) kepada aromatik. [2] Proses aromatisasi yang berkaitan termasuk penyahhidroisomeran metilsiklopentana kepada benzena:
Proses biokimia
[sunting | sunting sumber]Aromatase ialah enzim yang melakukan prosese aromatisasi kepada struktur cincin dalam sebatian steroid. Penukaran khusus ialah testosteron kepada estradiol dan androstenedion kepada estrone. [3] Setiap aromatisasi ini melibatkan pengoksidaan kumpulan metil C-19 untuk membolehkan penyingkiran asid formik bersamaan dengan aromatisasi. Penukaran sedemikian adalah relevan dengan tumorogenesis estrogen dalam perkembangan kanser payudara dan kanser ovari pada wanita menopause dan ginekomastia pada lelaki. [4] Inhibitor aromatase seperti exemestane (yang membentuk ikatan kekal dan menyahaktifkan dengan enzim aromatase) [5] dan anastrozole dan letrozole (yang bersaing untuk enzim) [6] telah terbukti lebih berkesan daripada ubat anti-estrogen seperti tamoxifen. Hal ini kerana ia menghalang pembentukan estradiol. [4]
Laluan aromatisasi
[sunting | sunting sumber]Dehidrogenasi oksidatif
[sunting | sunting sumber]Untuk sikloheksana, sikloheksena dan sikloheksadiena, penyahhidrogenan ialah laluan paling mudah dari segi konsep untuk aromatisasi. Halangan pengaktifan berkurangan dengan tahap ketidaktepuan. Oleh itu, sikloheksadiena sangat terdedah kepada aromatisasi. Secara formalnya, dehidrogenasi adalah proses redoks. Aromatisasi dehidrogenatif adalah kebalikan daripada penghidrogenan arene. Oleh itu, pemangkin penghidrogenan berkesan untuk tindak balas terbalik. Penyahhidrogenan bermangkin platinum bagi sikloheksana dan bahan suapan yang berkaitan ialah aplikasi skala terbesar bagi tindak balas ini (lihat di atas).
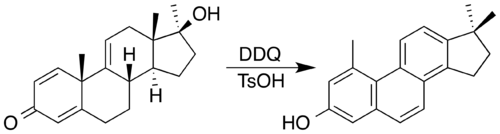
2,3-Dichloro-5,6-dicyano-1,4-benzoquinone (DDQ) selalunya merupakan reagen pilihan dalam proses dehidrogenasi oksidatif. DDQ dan pemangkin asid telah digunakan untuk mensintesis steroid dengan teras phenanthrene melalui pengoksidaan yang disertai dengan penghijrahan metil berganda. [7] Dalam proses itu, DDQ itu sendiri dikurangkan menjadi produk hidrokuinon aromatik.
Sulfur dan selenium secara tradisinya digunakan dalam aromatisasi, meninggalkan sebuah kumpulan kimia iaitu hidrogen sulfida . [8]
Kompleks logam transisi larut boleh mendorong aromatisasi oksidatif seiring dengan pengkompleksan. α-Phellandrene (2-metil-5- iso -propil-1,3-sikloheksadiena) dioksidakan kepada <i id="mwag">p</i> - <i id="mwaw">iso</i> -propyltoluena dengan pengurangan ruthenium triklorida. [9]
Dehidrogenasi oksidatif dihydropyridine menghasilkan aromatisasi, menghasilkan piridin. [10]
Dehidrasi
[sunting | sunting sumber]
Cincin bukan aromatik boleh diaromakan dalam pelbagai cara. Dehidrasi membenarkan tindak balas Semmler-Wolff bagi 2-sikloheksenon oksim berubah menjadi anilin dalam keadaan berasid. [11]
Tautomerisasi
[sunting | sunting sumber]
Pengisomeran sikloheksadienon menghasilkan fenol tautomer aromatik. [12] [13] Pengisomeran 1,4-naftalendiol pada 200 °C menghasilkan campuran 2:1 dengan bentuk ketonya, 1,4-dioxotetralin.[14]
Abstraksi hidrida dan proton
[sunting | sunting sumber]Secara klasik, tindak balas aromatisasi melibatkan perubahan nisbah C:H substrat. Apabila digunakan pada siklopentadiena, penyingkiran proton memberikan asas konjugat aromatik cyclopentadienyl anion, dan boleh diasingkan sebagai natrium siklopentadienida:[15]
- 2 Na + 2 C5H6 → 2 NaC5H5 + H2
Aromatisasi boleh melibatkan penyingkiran hidrida. Tropylium, C7H+
7 timbul daripada tindak balas aromatisasi sikloheptatriena dengan penerima hidrida.
- C7H8 + Br2 → C7H+
7 + Br− + HBr

Daripada prekursor asiklik
[sunting | sunting sumber]Aromatisasi prekursor asiklik adalah lebih jarang dalam sintesis organik, walaupun ia merupakan komponen yang penting dalam pengeluaran BTX dalam pusat penapisan.
Antara prekursor asiklik, alkuna agak terdedah kepada proses aromatisasi kerana ia terdehidrogenasi sebahagiannya. Kitaran Bergman menukarkan enediyne kepada diradikal perantaraan dehidrobenzena, yang mengabstraksi hidrogen untuk beraroma. [16] Bahagian enediyne boleh dimasukkan ke dalam struktur cincin sedia ada, membenarkan akses kepada sistem siklik dalam keadaan ringan akibat daripada terikan gelang dalam bahan tindak balas. Siklodeca-3-en-1,5-diyne bertindak balas dengan 1,3-cyclohexadiena untuk menghasilkan benzena dan tetralin pada 37 °C, tindak balas adalah sangat baik kerana pembentukan dua cincin aromatik baru:
Lihat juga
[sunting | sunting sumber]- Aromatase
- Hidrokarbon aromatik
Rujukan
[sunting | sunting sumber]- ^ Gary, J.H.; Handwerk, G.E. (1984). Petroleum Refining Technology and Economics (ed. 2nd). Marcel Dekker, Inc. ISBN 0-8247-7150-8.
- ^ Ono, Y. (1992). "Transformation of Lower Alkanes into Aromatic Hydrocarbons over ZSM-5 Zeolites". Catal. Rev. - Sci. Eng. 34 (3): 179–226. doi:10.1080/01614949208020306.
- ^ Lephart, E. D. (1996). "A Review of Brain Aromatase Cytochrome P450". Brain Res. Rev. 22 (1): 1–26. doi:10.1016/0165-0173(96)00002-1. PMID 8871783.
- ^ a b Avendaño, C.; Menéndez, J. C. (2008). "Aromatase Inhibitors". Medicinal Chemistry of Anticancer Drugs. Elsevier. m/s. 65–73. doi:10.1016/B978-0-444-52824-7.00003-2. ISBN 9780080559629.
- ^ Jasek, W., penyunting (2007). Austria-Codex (dalam bahasa German) (ed. 62nd). Vienna: Österreichischer Apothekerverlag. m/s. 656–660. ISBN 9783852001814.CS1 maint: unrecognized language (link)
- ^ Dinnendahl, V.; Fricke, U., penyunting (2007). Arzneistoff-Profile (dalam bahasa German). 4 (ed. 21st). Eschborn, Germany: Govi Pharmazeutischer Verlag. ISBN 9783774198463.CS1 maint: unrecognized language (link)
- ^ Brown, W.; Turner, A. B. (1971). "Applications of High-Potential Quinones. Part VII. The Synthesis of Steroidal Phenanthrenes by Double Methyl Migration". Journal of the Chemical Society C: Organic. 14: 2566–2572. doi:10.1039/J39710002566. PMID 5167256.
- ^ Bergmann, F.; Szmuszkowicz, J.; Fawaz, G. (1947). "The Condensation of 1,1-Diarylethylenes with Maleic Anhydride". Journal of the American Chemical Society. 69 (7): 1773–1777. doi:10.1021/ja01199a055. PMID 20251415.
- ^ Bennett, M. A.; Huang, T. N.; Matheson, T. W.; Smith, A. K. (1982). "(η6-Hexamethylbenzene)ruthenium Complexes". Inorganic Syntheses. 21: 74–78. doi:10.1002/9780470132524.ch16. ISBN 9780470132524.
- ^ Shimizu, S.; Watanabe, N.; Kataoka, T.; Shoji, T.; Abe, N.; Morishita, S.; Ichimura, H. (2005). "Pyridine and Pyridine Derivatives". Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a22_399. ISBN 3527306730.
- ^ Horning, E. C.; Stromberg, V. L.; Lloyd, H. A. (1952). "Beckmann Rearrangements. An Investigation of Special Cases". Journal of the American Chemical Society. 74 (20): 5153–5155. doi:10.1021/ja01140a048.
- ^ Clayden, J.; Greeves, N.; Warren, S.; Wothers, P. (2001). Organic Chemistry (ed. 1st). Oxford University Press. m/s. 531. ISBN 9780198503460.
- ^ Capponi, M.; Gut, I. G.; Hellrung, B.; Persy, G.; Wirz, J. (1999). "Ketonization Equilibria of Phenol in Aqueous Solution". Canadian Journal of Chemistry. 77 (5–6): 605–613. doi:10.1139/cjc-77-5-6-605.
- ^ Kündig, E. P.; Garcia, A. E.; Lomberget, T.; Bernardinelli, G. (2005). "Rediscovery, Isolation, and Asymmetric Reduction of 1,2,3,4-Tetrahydronaphthalene-1,4-dione and Studies of its [Cr(CO)3] Complex". Angewandte Chemie International Edition. 45 (1): 98–101. doi:10.1002/anie.200502588. PMID 16304647.
- ^ Cotton, F. A.; Wilkinson, G. (1999). Advanced Inorganic Chemistry (ed. 6th). John Wiley and Sons. ISBN 9780471199571.
- ^ "Concerted Reactions that Produce Diradicals and Zwitterions: Electronic, Steric, Conformational and Kinetic Control of Cycloaromatization Processes". Chemical Reviews. 113 (9): 7089–7129. 2013. doi:10.1021/cr4000682. PMID 23600723.